Mejora de la respuesta inmune anti-tumoral con hipertermia moderada
El uso de la hipertermia como complemento de la inmunoterapia contra el cáncer está respaldado por un número creciente de datos de investigación. Tanto los resultados de los datos preclínicos como clínicos han demostrado respuestas inmunitarias antitumorales mejoradas con la adición de hipertermia moderada. Los mecanismos moleculares responsables de la reactivación inmune mejorada observada en presencia de hipertermia incluyen la generación de Hsps (familia de proteínas que se producen por las células en respuesta a la exposición a condiciones de estrés como shock de calor), la activación de células presentadoras de antígeno y los cambios en el tráfico de linfocitos.
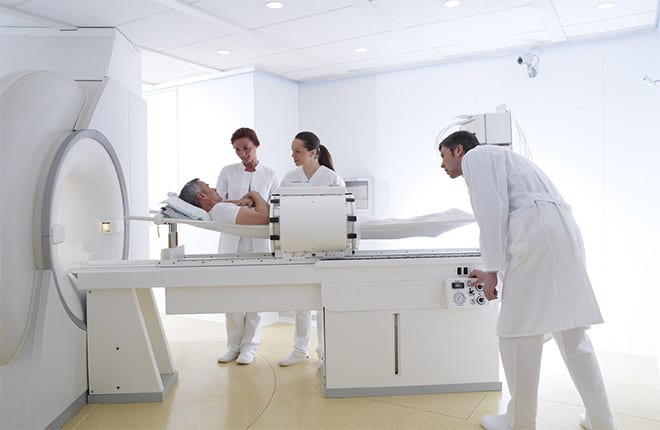
Las temperaturas del cuerpo elevadas han sido reconocidas como componentes beneficiosos de la respuesta de defensa inmune contra los estímulos patogénicos desde épocas antiguas, y la noción de tratar cánceres humanos con calor se remonta a los escritos de Hipócrates. Sin embargo, el calor como una modalidad de tratamiento para el cáncer sólo ha comenzado a ser evaluado rigurosamente en las últimas décadas. Hay un interés renovado en la aplicación de calor para mejorar la eficiencia de las terapias estándar de cáncer, como la quimioterapia y la radioterapia. La combinación de inmunoterapia con hipertermia para el tratamiento del cáncer, sin embargo, es una noción particularmente intrigante, ya que los efectos clínicos significativos de la hipertermia se han atribuido al sistema inmune. La visión aceptada de la interfaz inmune de cáncer-huésped es que los tumores poseen antígenos únicos que pueden ser reconocidos por el sistema inmune. Después de la captación de antígenos en los sitios de los tumores, las APCs o células presentadoras de antígenos (o también llamadas células dendríticas) tienen la capacidad de crear una respuesta potente entrando en los compartimentos linfoides y programando linfocitos. Después de la generación y la expansión a un número muy elevado, los linfocitos citotoxicos pueden, a continuación, viajar al lugar del tumor para eliminar las células cancerosas.
Para comprender como la temperatura puede influir en el sistema inmune, es necesario definir el concepto de hipertermia. Como padre de la termometría clínica, Wunderlich se acredita con la definición de las temperaturas normales del cuerpo a 37 ° C y describe un rango dinámico de las temperaturas normales del cuerpo con variaciones diurnas. La fiebre induce la elevación del punto de ajuste fisiológico de la temperatura corporal, aumentando las temperaturas corporales centrales a través de termolectores específicos. La hipertermia difiere fundamentalmente de la fiebre en que eleva la temperatura corporal central sin cambiar el punto de ajuste fisiológico. Normalmente, la hipertermia se induce por el aumento de la carga de calor y / o inactivar la disipación de calor.

Los primeros estudios de hipertermia se centraron en los efectos citotóxicos de altas temperaturas y la muerte directa de células tumorales. A pesar de que la muerte celular significativa se pudo lograr calentando células o tejidos a temperaturas > 42 °C durante 1 o más horas, la aplicación, medida y consistencia de este rango de temperatura dentro del establecimiento de ensayos clínicos de cáncer resultó problemático. A menos que la ablación térmica del tejido tumoral se aplique dentro de un área localizada, la hipertermia en el rango citotóxico no se pudo lograr de manera confiable en tumores de tamaño y tipo de tejido heterogéneos. Por lo tanto, la hipertermia a temperatura leve (es decir, dentro de la gama fiebre, 39-41°C) y la hipertermia moderada (41° C) han surgido como puntos focales para las investigaciones clínicas en curso, ya que son fácilmente alcanzables y tolerados. Nos centramos en Hsps y APCs y la mejora de las estrategias de inmunoterapia.
Funciones celulares de Hsps
Las Hsps son una familia de proteínas inducidas por el estrés con varias funciones celulares críticas, y son típicamente designadas por su peso molecular. Las Hsps fueron descubiertas en 1962 como resultado de la aplicación accidental de estrés térmico a los preparados de Drosophila. En los últimos 30 años, las Hsps se han caracterizado en una variedad de células, en especies que van desde procariotas a los seres humanos, y están altamente conservadas. Las Hsps atenúan los efectos de los factores de estrés celular. Son ahora reconocidas como mediadores centrales de una variedad de funciones celulares en condiciones fisiológicas, ya que son los principales reguladores de la actividad de las proteínas celulares. Durante la homeostasis, las Hsps garantizan el plegamiento post-translacional de proteínas adecuado, y son capaces de replegar las proteínas desnaturalizadas, o marcar las proteínas irreversiblemente dañadas para la destrucción. No es de sorprender, dado sus actividades celulares cruciales, que las Hsps representen uno de los tipos de proteínas más abundantes en las células no estresadas, representando el 1-2% de todas las proteínas citosólicas Definir la función de las Hsps en las células cancerosas se ha convertido en un área floreciente de investigación, como se describe a continuación.
Hsps en el cáncer
Las actividades de Hsps en las células tumorales transformadas son complicadas y diversas. Las Hsps están presentes en abundancia en varios tipos tipos de tumores y pueden conferir varios beneficios de supervivencia a las células cancerosas. Hay pruebas de que una específica Hsp, Hsp70, directamente inhibe las vías de apoptosis en las células cancerosas, como se ha demostrado en el cáncer de páncreas humanos, próstata y células de cáncer gástrico. Las Hsps también han sido implicadas en la mediación de resistencia a la hipertermia potencialmente citotóxica en un proceso denominado termotolerancia. Más específicamente, la síntesis y acumulación de Hsps en células tumorales expuestas a hipertermia puede proporcionar protección frente a otros eventos citotóxicos asociados al calor, ya que las Hsps pueden rescatar o restaurar proteínas celulares vitales. La termotolerancia tiene la capacidad de generar una población de células tumorales que son refractarias a los cambios hipertérmicos posteriores. Por otra parte, hay pruebas de que las Hsps apoyan el fenotipo maligno de las células cancerosas, no sólo afectan a la supervivencia de las células, sino que también participan en la angiogénesis, la invasión, las metástasis y los mecanismos de inmortalización Contrariamente a los muchos beneficios conferidos a las células tumorales que expresan altos niveles de Hsps, la dependencia de células tumorales de Hsps para varias funciones críticas representa un atractivo y potencial objetivo terapéutico; un talón de Aquiles virtual.
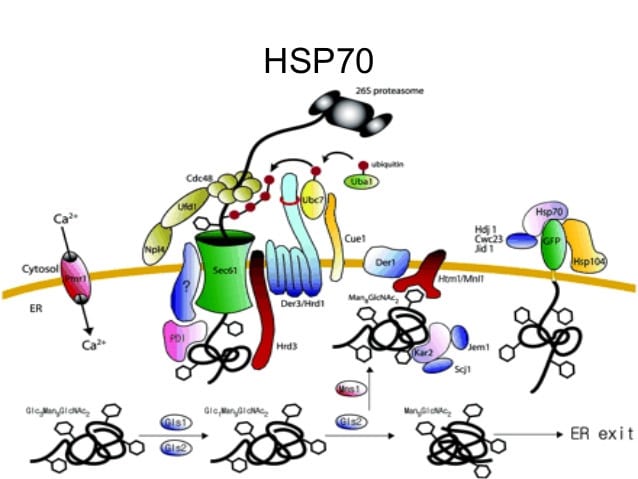
Hsps y sistema inmune
El sistema inmune ha evolucionado para aprovechar la capacidad de las Hsps para actuar como «señales de peligro», lo que permite la generación de una respuesta inmune amplificada. Las Hsp liberadas de células estresadas o moribundas activan las células dendríticas (DC), transformándolas en APCs maduras. La endocitosis de Hps por DCs aumenta la expresión de la superficie celular de la clase II de moléculas MHC, además de varias moléculas coestimuladoras, lo que potencia el reconocimiento inmune de los antígenos. Las células dentríticas (DC) maduras pueden programar células efectoras de linfocitos de una manera restringida a antígeno, limitando así el daño colateral a tejidos sanos normales, que no expresan el antígeno diana. La capacidad de Hsps para acompañar a las proteínas antes de la endocitosis y el procesamiento por DCs potencialmente puede ampliar el repertorio de epítopos presentados y, por tanto, el espectro de la respuesta inmune.
En Biosalud Day hospital hemos incorporado a nuestras técnicas específicas para el tratamiento complementario del cáncer la hipertermia, formando parte de un protocolo desarrollado por nuestro Departamento de I+D+i, aumentando hasta 10 veces la efectividad de las células dendríticas en cuanto a la capacidad de destrucción de las células cancerosas, aumentando la angiogénesis y por tanto la oxigenación de la zona tumoral (cosa contraria a lo que precisan las células cancerosas) y poniendo en marcha los mecanismos de apoptosis de las células cancerosas.
Todo ello hace que Biosalud Hospital de Día pueda aplicar de forma personalizada el protocolo más adecuado a cada caso, que permita complementar del modo más eficaz al tratamiento convencional prescrito por el oncólogo y reduciendo en gran medida los efectos secundarios del mismo.
En el cáncer, tratamos de sumar técnicas complementarias que nos ofrezcan las mayores posibilidades de éxito, dada la complejidad de cada caso.
