Bloqueo del flujo de calcio a la mitocondria
Un nuevo estudio demuestra que el bloqueo de la transferencia de los iones de calcio (Ca2 +) a las mitocondrias es tóxico para las células cancerosas y afecta el crecimiento de tumores en ratones, sin afectar las células normales.
Todas las células utilizan iones de calcio como agentes de señalización para regular el metabolismo y otras funciones celulares. Bloqueando el flujo de calcio en las mitocondrias, que son las principales productoras de moléculas ATP ricas en energía en las células (moléculas utilizadas por todos los organismos vivos para proporcionar energía en las reacciones químicas), se creó una «crisis» de energía de la cual las células normales pudieron recuperarse, pero las células de cáncer no pudieron, según el estudio.
Los nuevos hallazgos sugieren que la adicción mitocondrial al calcio es una nueva característica de las células cancerosas que podría ser explotada para desarrollar nuevas y dirigidas terapias contra el cáncer, dijo en un comunicado de prensa el autor principal del estudio, Kevin J. Foskett, Ph.D., de la Universidad de Pennsylvania.
Los resultados del estudio fueron publicados en Cell Reports el 3 de marzo.
Una crisis de energía celular
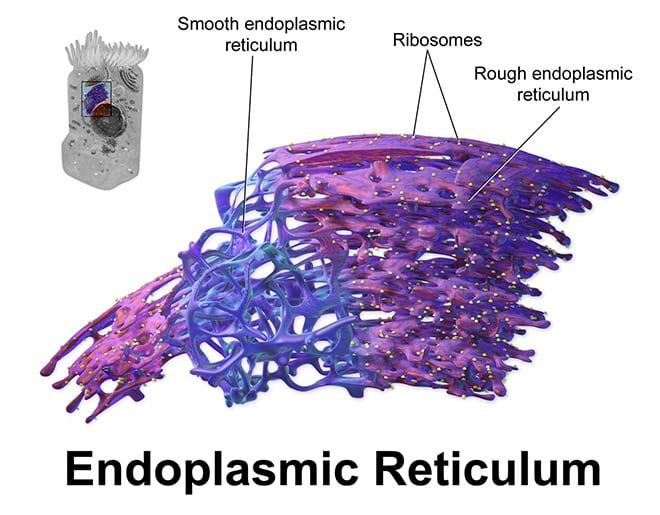
Las mitocondrias son compartimentos (orgánulos) dentro de las células que descomponen los nutrientes para producir energía en forma de ATP, que utilizan las células para las reacciones bioquímicas de potencia. Anteriores trabajos de laboratorio del Dr. Foskett demostraron que los iones de calcio son constantemente transportados a la mitocondria desde otro compartimento celular, el retículo endoplásmico, o ER. Este curso de transferencia de calcio entre el ER y las mitocondrias ayuda a mantener la producción de ATP a través de un proceso metabólico llamado fosforilación oxidativa.
Las proteínas receptoras especializadas llamadas InsP3Rs forman canales que atraviesan la membrana ER y permiten que el calcio fluya hacia fuera de una manera controlada. Los iones de calcio liberados desde ER se mueven luego a las mitocondrias adyacentes.
Trabajando con líneas celulares, el equipo de investigación, co-dirigido por César Cárdenas, Ph.D., de la Universidad de Chile, usó un compuesto encontrado en las esponjas de mar, llamado XEB, que inhibe el InsP3Rs, impidiendo el flujo de calcio desde el RE a las mitocondrias. Se examinaron los efectos de XEB en líneas de células de cáncer humanas derivadas de cánceres de mama y de próstata, en células de fibroblastos humanos que habían sido transformadas en células cancerosas y en células normales comparables.
Cuando el flujo de calcio a las mitocondrias fue bloqueado por XEB, tanto las células cancerosas como en las células normales experimentaron una «crisis bioenergética» que se caracteriza por la producción de ATP reducida y por otras señales de metabolismo celular más lentas. Confirmando el trabajo previo de laboratorio del Dr. Foskett, las células normales sobrevivieron a esta crisis de energía mediante la activación de un mecanismo conocido como autofagia. En la autofagia, o «auto-alimentación,» las células reciclan componentes de la célula para mantener los niveles de energía en condiciones de inanición o estrés. Las células cancerosas también activaron la autofagia cuando el flujo de calcio fue bloqueado, pero la respuesta de auto-alimentación no fue suficiente para evitar la muerte de las células cancerosas.
Otros experimentos demostraron que el bloqueo de la transferencia de calcio causado a las células normales hace que dejen de dividirse, lo cual es una respuesta esperada cuando la energía es escasa. Por el contrario, las células cancerosas tratadas de la misma manera continuaron dividiéndose, pero luego se sometieron a la muerte celular durante la última fase de la división celular.
Usando un modelo de melanoma de ratón, los investigadores también encontraron que el bloqueo de la actividad InsP3R a través de una única inyección de XEB reduce el tamaño del tumor en casi un 60 por ciento en un día en comparación con los tumores no tratados. En otra serie de experimentos con ratones, el tratamiento con XEB cada dos días durante una semana reduce el tamaño del tumor de melanoma en un 70 por ciento en comparación con los tumores no tratados en el mismo animal.
Una inesperada diana terapéutica
«Nuestros estudios sugieren la existencia de nuevas dianas completamente inesperadas por las cuales se podrían desarrollar medicamentos para matar las células cancerosas específicamente apuntando a la liberación de calcio desde ER y la absorción de calcio por la mitocondria,» dijo el Dr. Foskett.
«Este trabajo y trabajos anteriores de otros grupos aportan pruebas convincentes de que la señalización de calcio se ve alterada en las células cancerosas«, dijo Gregory Monteith, Ph.D., de la Universidad de Queensland, Australia, que no participó en el estudio.
«En el caso específico de la transferencia de calcio desde el RE a la mitocondria, ahora tenemos que desarrollar una mejor comprensión de que las proteínas en esta vía podrían ser dirigidas farmacológicamente y garantizar que, cuando son moduladas, esto no va a tener efectos sustanciales en otros tipos de células que podrían dar lugar a efectos secundarios prohibitivos «, dijo el Dr. Monteith.
El Dr. Foskett y su equipo están trabajando para diseñar ensayos de alto rendimiento basados ‹‹en la línea celular (pruebas de laboratorio) para analizar fármacos potenciales que podrían afectar a uno o más de estos nuevos objetivos. «También tenemos planes para asociarnos con los biólogos del cáncer para desarrollar algunos mejores modelos animales para probar nuestra hipótesis y avanzar en diferentes tipos de cáncer, para ver si lo que hemos visto en líneas celulares y en un tipo de tumor se mantiene en modelos más robustos «.
«La comprensión de cómo los patrones de comunicación entre los orgánulos se mantienen o se alteran en las células del cáncer es un área emergente en el campo de la biología del cáncer,» dijo Michael Espey, Ph.D., de la rama de Biología Celular del Cáncer en la División de Biología del Cáncer del NCI. «El hallazgo de que las células cancerosas se vuelven abiertamente dependientes de flujo de iones de calcio de ER-a las mitocondrias abre nuevas vías para el diseño de tratamientos que podrían aprovechar esta vulnerabilidad.»
