Terapias celulares para estimular la regeneración
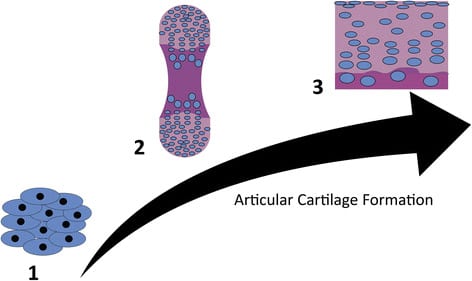
Durante mucho tiempo, el cartílago ha sido un foco importante en el campo de la ingeniería de tejidos, tanto debido a la necesidad creciente de opciones más eficaces para la reparación de las articulaciones como a la expectativa de que este tejido aparentemente simple será fácil de diseñar.
Después de varias décadas, los tratamientos de regeneración del cartílago debe mezclar la terapia celular, los biomateriales, y la ingeniería de tejidos, para la reparación del cartílago articular sin fisuras.
Las células son la fuerza motriz de la formación de cartílago y del mantenimiento continuo de tejido. Las terapias con células utilizan la implantación de células cultivadas externamente para replicar y estimular la regeneración nativa. Los condrocitos maduros fueron las primeras células que encontraron aplicación clínica para la regeneración del cartílago. Similar a los autoinjertos y aloinjertos, el uso de condrocitos maduros se basa en la premisa de que las células nativas, maduras, son las más adecuadas para guiar la regeneración.
Implantación de condrocitos autólogos
Los condrocitos maduros en aplicaciones de terapia celular se han utilizado principalmente en una técnica denominada implantación de condrocitos autólogos (ACI). La ACI se inicia cultivando y aislando enzimáticamente condrocitos de un área de soporte de carga menor del cartílago dañado del paciente. Como el cartílago tiene baja densidad celular, los condrocitos aislados tienen que ser expandidos in vitro para obtener suficientes células para un tratamiento eficaz. En la terapia de ACI, una membrana se coloca sobre el área de defecto que se llena con una suspensión de condrocitos y se sutura en el cartílago circundante para asegurar la localización de condrocitos dentro del defecto. Inicialmente, un trozo de periostio cortado del hueso del paciente era usado como membrana, probablemente contribuyendo aún más a la regeneración del cartílago como una fuente adicional de células. Más tarde, también se utilizaron membranas sintéticas hechas de una mezcla de colágeno I / III.
Si bien los ensayos clínicos reportaron resultados de buenos a excelentes para la casi totalidad de los pacientes a los 66 meses, más ensayos clínicos aleatorizados demostraron que la ACI no realizó ninguna mejor con respecto a las cirugías de microfractura. También se observaron algunas limitaciones. Cuando se expanden sobre plástico in vitro, los condrocitos articulares cultivados tienden a desdiferenciarse y empezar a producir cantidades sustanciales de colágeno de tipo I. Tal expansión y desdiferenciación puede dificultar la formación de cartílago hialino y dar lugar a una diferenciación de condrocitos hipertrófica cuando se implantan de nuevo en el defecto. En consecuencia, se ha observado que el cartílago formado siguiendo un procedimiento tradicional ACI tiende a parecerse histológicamente a fibrocartílago en lugar de a cartílago articular. El fibrocartílago es una versión densa, fibrosa de cartílago, que carece de la resistencia a la compresión y las propiedades de fricción del cartílago hialino. La presencia de fibrocartílago causa problemas similares a los del trasplante de autoinjertos de cartílago articular, en los que la falta de integración y falta de coincidencia en las propiedades funcionales limitan la regeneración completa del defecto. Con los años, la ACI ha sido objeto de numerosas mejoras, que han cambiado el procedimiento ACI de ser calificado como una terapia celular a ser una terapia de ingeniería de tejidos.
Células madre mesenquimales
El uso de células madre mesenquimales (MSC) puede aliviar dos limitaciones fundamentales de los condrocitos autólogos: la morbilidad del sitio donante y la producción limitada de matriz después de la expansión celular. Las MSCs se pueden cultivar a partir de un número de fuentes que no afectan a la actividad del cartílago manteniendo multipotencia después de numerosas expansiones, y pueden diferenciarse en condrocitos que producen matriz. Además, las células madre mesenquimales tienen propiedades inmunomoduladoras y se ha demostrado que suprimen citoquinas proinflamatorias. Sin embargo, actualmente se está debatiendo si las MSC condrogénicamente diferenciadas están programadas para progresar hacia la diferenciación terminal y la formación de hueso. Principalmente debido a sus propiedades favorables, y a pesar del debate actual, las células madre mesenquimales se estudian y se utilizan cada vez más para el tratamiento de defectos de cartílago y la artrosis.
Para los defectos del cartílago, la aplicación de MSCs es similar al método de ACI, y ha producido resultados similares. En una comparación de los procedimientos basados en ACI y MSCs, no hubo diferencias significativas en el resultado clínico. Si bien los resultados de la terapia de tipo ACI usando MSCs son prometedores, todavía persisten problemas similares a los observados en el tratamiento tradicional ACI. Es importante destacar que las células madre mesenquimales son una población heterogénea de células que pueden generar fibrocartílago y condrocitos hipertróficos junto con los condrocitos articulares productores de cartílago deseados. Los estudios han mostrado cartílago no articular que se forma dentro del defecto después de la implantación, y esta situación se asocia con pobres resultados clínicos.
Células madre pluripotentes inducidas
En los intentos para derivar de forma más consistente condrocitos articulares que producen matriz y regeneran el cartílago, los investigadores han recurrido a fuentes de células madre pluripotentes: células madre embrionarias (CME) y células madre pluripotentes inducidas (iPSCs). Mientras que el uso de las células madre embrionarias está muy debatido debido a la ética de su derivación, las iPSCs proporcionan pluripotencia similar sin el dilema ético. Además, las iPSCs pueden ser autólogas, ya que se pueden derivar de pequeñas muestras de diversos tejidos, incluyendo la piel y la sangre. La derivación de los condrocitos de las CME o iPSCs se puede lograr por MSCs derivadas o mediante la diferenciación de las células directamente en condrocitos. En general, el uso de células madre pluripotentes para la regeneración del cartílago es muy prometedor. En comparación con los condrocitos derivados de MSC, los condrocitos diferenciados a partir de células madre pluripotentes tuvieron mayor expresión génica de los condrocitos y los genes productoras de cartílago (COL2A1, AGC, SOX9), y redujeron la expresión de los genes hipertróficos y productores de hueso (COL10A1, COL1A1, RUNX2) [22]. Numerosos estudios han demostrado la capacidad de estas células para producir cartílago como el articular integrado con el cartílago nativo y el hueso subcondral cuando se implantan en un defecto de un animal.
La capacidad de las células madre pluripotentes para diferenciarse en las tres capas germinales y recapitular el fenotipo de células productoras de cartílago nativo es muy atractiva para la regeneración del cartílago, pero existen desafíos clave en la producción de manera eficiente y segura y el control de estas células. A pesar de que los recientes avances han mejorado la eficiencia de la generación de IPSC, los rendimientos siguen siendo bajos para la producción masiva. Además, la implantación de células madre pluripotentes ha dado lugar de vez en cuando en la formación de teratoma (tumor encapsulado con componentes de tejidos u órganos que recuerdan los derivados normales de las tres capas germinales)
Actualmente se está investigando la manera de superar las limitaciones actuales y producir cartílago viable, funcional, duradero y capaz de integrarse con los tejidos circundantes.

muy interesante lo que podemos lograr con la manipulación de células madres en bien de la salud . quiero especializarme mas en ello necesito información.
Muchas gracias Mike por tu participación. Pasamos tu consulta a clínica y te responderán en breve. Un saludo
muy interesante lo que podemos lograr con la manipulación de células madres en bien de la salud . quiero especializarme mas en ello necesito información.
Muchas gracias Mike por tu participación. Pasamos tu consulta a clínica y te responderán en breve. Un saludo
Muchas gracias por la información!!…
Muchas gracias por la información!!…